762 阅读 2021-01-20 09:35:04 上传
以下文章来源于 马丁适用语言学研究中心
一、中高级别软组织肉瘤的儿童和成人患者接受术前放化疗加或不加帕唑帕尼(pazopanib)的病理反应[1]
这是一项在美国开展的多中心、随机、开放标签的2期临床试验。共招募入组了81名患者。其结论是帕唑帕尼+新辅助放化疗能够显著提高软组织肉瘤患者的病理反应率(图1所示)。但是否能够改善生存期需要更长时间的随访。
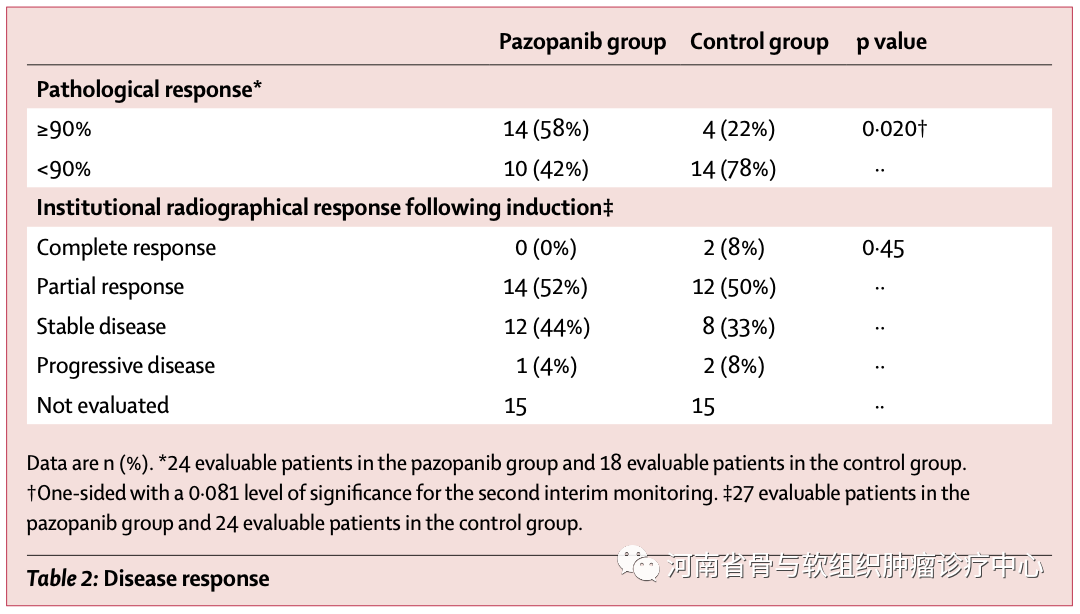

图1:帕唑帕尼联合新辅助放化疗组(Pazopanib group)与新辅助放化疗组(Control group)的治疗反应率对比。
二、多柔比星联合奥拉单抗(Olaratumab)vs多柔比星联合安慰剂对晚期软组织肉瘤患者生存的影响[2]
这是一项全球多国参与的一项3期、双盲、随机试验。共招募入组了509名患者。其结论是多柔比星联合奥拉单抗治疗与多柔比星联合安慰剂治疗在总生存期上没有显著差异(图2所示)。这一发现并没有证实2期临床试验中观察到的总生存益处。

图2: 多柔比星联合奥拉单抗(Doxorubicin+olaratumab)与多柔比星联合安慰剂(Doxorubicin+placebo)分别治疗软组织肉瘤的总生存期对比。
三、多柔比星和派姆单抗(Pembrolizumab,K药)用于初诊晚期肉瘤患者的疗效和安全性评估[3]
这是一项在美英两国开展的1/2期非随机临床试验。共有37例患者入组。2期阶段患者的ORR为13%,总ORR为19%。中位PFS为8.1个月。2 / 3的未分化多形性肉瘤和2 / 4的去分化脂肪肉瘤患者有持久的部分反应(图3所示)。其结论是多柔比星联合派姆单抗耐受性良好。虽然没有达到ORR的主要终点,但PFS和OS与之前发表的研究相比比较良好。需要进一步的研究,特别是对未分化多形性肉瘤和去分化脂肪肉瘤的研究。

图3: 多柔比星联合K药治疗晚期软组织肉瘤的疗效。
四、曲贝替定(trabectedin)联合低剂量放疗治疗转移性软组织肉瘤的安全性和有效性评估[4]
这是一项在欧洲多国开展的非随机的1/2期临床试验。1期入组了18例患者,2期入组了27例患者。本研究结果表明,曲贝替定与30Gy的辐照方案联合使用的推荐剂量为1.5 mg/m2。该试验达到了主要终点,总体缓解率高,表明在转移性进展性软组织肉瘤患者中,这种联合疗法比一线系统治疗更有潜力实现实质性的肿瘤收缩(图4所示)。

图4: 曲贝替定联合低剂量放疗治疗软组织肉瘤的疗效。
五、帕唑帕尼(Pazopanib)用于治疗典型的孤立性纤维性肿瘤[5]
这是在西班牙和法国开展的一项多中心,单臂,二期试验。最终31名患者被纳入响应分析。其结论是帕唑帕尼在该队列中显示的可控制的毒性和活性,表明该药物可被视为晚期典型的孤立性纤维肿瘤的一线治疗(图5所示)。

图5:帕唑帕尼治疗孤立性纤维肿瘤的疗效。
六、局部晚期或转移性肉瘤患者接受Talimogene Laherparepvec(商品名Imlygic,一种溶瘤病毒新药)联合派姆单抗(K药)治疗的疗效[6]
这项开放标签、单机构的2期临床试验在美国进行,共纳入了20例局部晚期或转移性肉瘤。该研究达到了其主要终点,即在24周的最佳ORR为30%(图6所示)。3级治疗相关不良事件发生率较低(4例[20%])。无4级治疗相关不良事件或治疗相关死亡。其结论是Imlygic联合派姆单抗治疗在一系列肉瘤组织学亚型的晚期肉瘤中与抗肿瘤活性相关,且具有可管理的安全性。
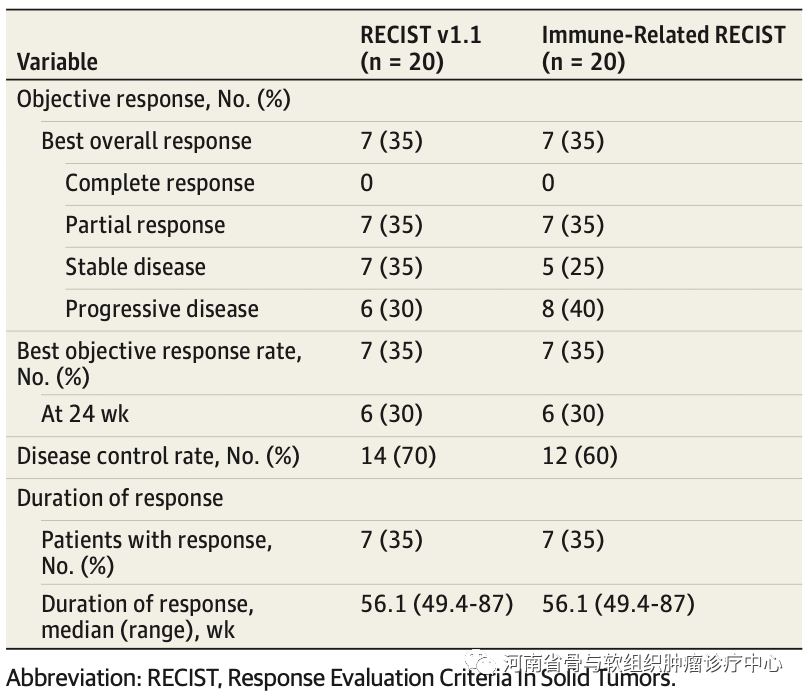
图6:Imlygic联合K药治疗晚期软组织肉瘤的疗效。
七、高危软组织肉瘤的新辅助化疗[7]
这是一项在欧洲多国开展的随机、开放标签的3期临床试验。共招募入组了287名患者。其结论是在局部高危软组织肉瘤患者群体中,新辅助化疗方案应该选择多柔比星+异环磷酰胺的方案(图7所示)。

图7:多柔比星+异环磷酰胺方案(Standard CT)与组织定制型方案(HT CT)在软组织肉瘤新辅助化疗中的疗效对比。
八、Tazemetostat(EZH2抑制剂,在美国上市的一种新药)在INI1/SMARCB1缺失的晚期上皮样肉瘤中的作用[8]
这是一项全球多国参与的开放标签,2期临床研究;共招募了62名患者,其中有9例(15%)在数据截止时有客观反应。其结论是Tazemetostat在以INI1/SMARCB1缺失为特征的晚期上皮样肉瘤患者队列中表现出良好的耐受性和临床活性(图8所示)。Tazemetostat联合多柔比星作为一线药物的1b/3期临床试验目前正在进行中(NCT04204941)。

图8: Tazemetostat治疗晚期上皮样肉瘤的疗效。
九、帕唑帕尼对比多柔比星作为年龄大于60岁的转移性软组织肉瘤患者的一线治疗的疗效和安全性[9]
这是在德国开展的一项随机对照2期临床试验。其中81例患者给予帕唑帕尼治疗,39例给予多柔比星治疗。其结论是帕唑帕尼并不劣于多柔比星,表明帕唑帕尼是60岁以上软组织肉瘤患者一线治疗的首选。

图9: 帕唑帕尼与多柔比星在老年软组织肉瘤患者中的疗效对比。
十、卡博替尼(Cabozantinib)治疗晚期尤文氏肉瘤或骨肉瘤的疗效和安全性研究[10]
这是一项在法国开展的多中心、单臂、2期临床试验。共有90例患者(45例尤文氏肉瘤45例骨肉瘤)被招募到研究中。在尤文氏肉瘤患者中,10例(26%)的患者有客观缓解;在骨肉瘤患者中,5例(12%)有客观缓解(图10所示)。其结论是卡博替尼在晚期尤文氏肉瘤和骨肉瘤患者中具有抗肿瘤活性,且普遍耐受性良好。值得进一步研究。

图10:卡博替尼治疗尤文肉瘤和骨肉瘤的疗效。
十一、阿帕替尼联合卡瑞丽珠单抗在晚期骨肉瘤中的安全性和有效性研究[11]
这是一项在北京大学人民医院开展的单臂、开放标签、2期临床试验。共入组了43例患者。其结论是虽然在治疗晚期骨肉瘤时,与单药阿帕替尼相比,联合治疗似乎延长了PFS,但它并没有达到预定的6个月PFS 60%或更高的目标。PD-L1的过表达和肺转移的存在与PFS的延长有关。
十二、阿帕替尼在晚期脊索瘤患者中的应用研究[12]
这是一项在上海长征医院开展的单臂、单中心、2期临床试验。在按方案治疗的27名患者中,有1名患者达到客观缓解,7例符合Choi标准的客观反应。根据RECIST,中位无进展生存期为18个月,根据Choi标准为18个月。作者的结论是阿帕替尼显示出有希望的活性和可控的毒性,因此可能是治疗晚期脊索瘤的一个选择。
十三、帕唑帕尼用于手术不能切除或转移性软骨肉瘤患者的研究[13]
这是一项在美国开展的单臂、多中心、2期临床试验。结果:47例患者入选。16周时DCR为43%。一名患者有部分反应(图11所示)。中位总生存期为17.6个月,中位无进展生存期为7.9个月。作者的结论是帕唑帕尼在晚期软骨肉瘤中有部分活性。
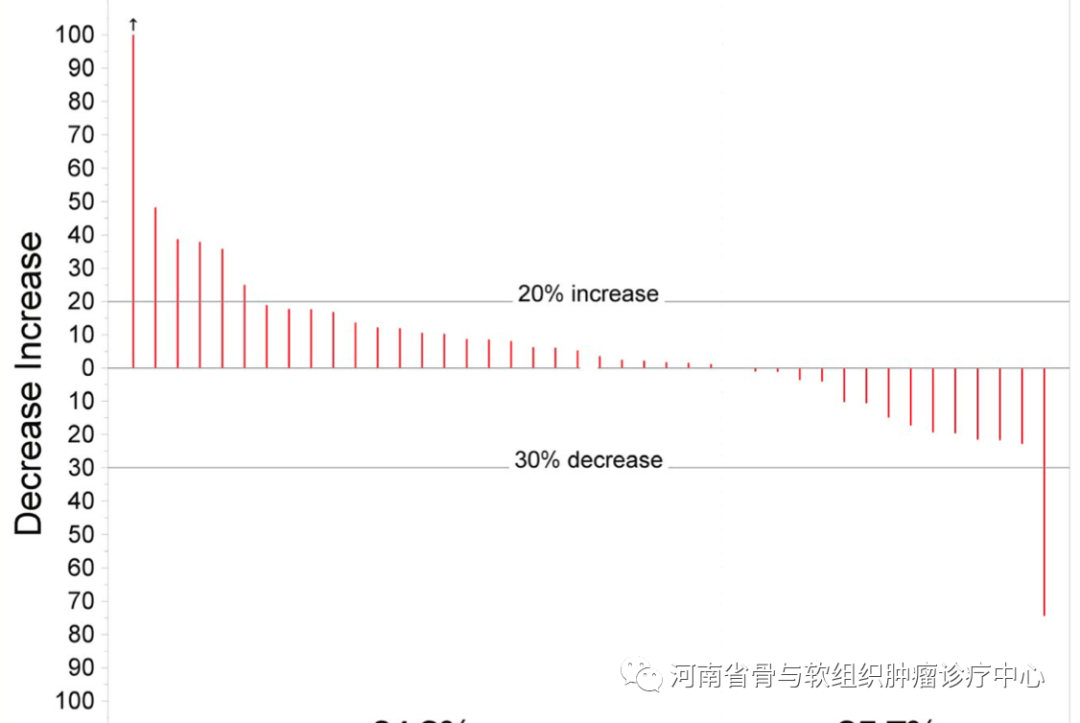
图11:帕唑帕尼治疗软骨肉瘤的治疗反应。
参考文献:
1. Weiss AR, et al: Pathological response in children and adults with large unresected intermediate-grade or high-grade soft tissue sarcoma receiving preoperative chemoradiotherapy with or without pazopanib (ARST1321): a multicentre, randomised, open-label, phase 2 trial. The Lancet Oncology 2020, 21(8):1110-1122.
2. Tap WD, et al: Effect of Doxorubicin Plus Olaratumab vs Doxorubicin Plus Placebo on Survival in Patients With Advanced Soft Tissue Sarcomas: The ANNOUNCE Randomized Clinical Trial. JAMA 2020, 323(13):1266-1276.
3. Pollack SM, et al: Assessment of Doxorubicin and Pembrolizumab in Patients With Advanced Anthracycline-Naive Sarcoma: A Phase 1/2 Nonrandomized Clinical Trial. JAMA Oncol 2020.
4. Martin-Broto J, et al: Assessment of Safety and Efficacy of Combined Trabectedin and Low-Dose Radiotherapy for Patients With Metastatic Soft-Tissue Sarcomas: A Nonrandomized Phase 1/2 Clinical Trial. JAMA Oncol 2020, 6(4):535-541.
5. Martin-Broto J, et al: Pazopanib for treatment of typical solitary fibrous tumours: a multicentre, single-arm, phase 2 trial. The Lancet Oncology 2020, 21(3):456-466.
6. Kelly CM, et al: Objective Response Rate Among Patients With Locally Advanced or Metastatic Sarcoma Treated With Talimogene Laherparepvec in Combination With Pembrolizumab: A Phase 2 Clinical Trial. JAMA Oncol 2020, 6(3):402-408.
7. Gronchi A, et al: Neoadjuvant Chemotherapy in High-Risk Soft Tissue Sarcomas: Final Results of a Randomized Trial From Italian (ISG), Spanish (GEIS), French (FSG), and Polish (PSG) Sarcoma Groups. J Clin Oncol 2020, 38(19):2178-2186.
8. Gounder M, et al: Tazemetostat in advanced epithelioid sarcoma with loss of INI1/SMARCB1: an international, open-label, phase 2 basket study. The Lancet Oncology 2020, 21(11):1423-1432.
9. Gr®πnwald V, et al: Randomized Comparison of Pazopanib and Doxorubicin as First-Line Treatment in Patients With Metastati c Soft Tissue Sarcoma Age 60 Years or Older: Results of a German Intergroup Study. J Clin Oncol 2020, 38(30):3555-3564.
10. Italiano A, et al: Cabozantinib in patients with advanced Ewing sarcoma or osteosarcoma (CABONE): a multicentre, single-arm, phase 2 trial. The Lancet Oncology 2020, 21(3):446-455.
11. Xie L, et al: Apatinib plus camrelizumab (anti-PD1 therapy, SHR-1210) for advanced osteosarcoma (APFAO) progressing after chemotherapy: a single-arm, open-label, phase 2 trial. J Immunother Cancer 2020, 8(1).
12. Liu C, et al: Apatinib in patients with advanced chordoma: a single-arm, single-centre, phase 2 study. Lancet Oncol 2020, 21(9):1244-1252.
13. Chow W, et al: Results of a prospective phase 2 study of pazopanib in patients with surgically unresectable or metastatic chondrosarcoma. Cancer 2020, 126(1):105-111.
图、文:田志超 校:姚伟涛