来自耶鲁大学医学院精神病学系的Joy Hirsch等人,最近在social cognitive and affective neuroscience上发文,他们使用近红外超扫描方法研究人与人之间口头交流的神经机制。尽管研究调节动态社会互动的神经机制具有进化意义,但该领域仍未得到深入研究。交互式大脑假说提出,交互式社交线索由脑内的专门区域进行处理,并为研究社交交互的潜在神经机制提供了一般的理论框架。本研究测试了这一假说,该假说提出,在基于交谈和聆听的社交互动过程中,规范的语言区域会被正调节并在脑间进行动态耦合。使用功能近红外光谱(fNIRS)获取同伴(被试)大脑中同步发生的脱氧血红蛋白(deOxyHb)信号,这些被试在有互动和没有互动的自然交流环境中进行对象命名和描述任务,他们会轮流执行描述和聆听任务。互动和非互动条件的比较证实了互动过程中,威尔尼克区(Wernicke)的颞上回(STG,superior temporal gyrus)相关的神经活动有所增加(P = 0.04)。但是,布罗卡区(Broca)的结果不支持该假设。通过小波分析STG和中央下区域(subcentral area)的信号,发现跨脑活动相干在交互过程中比非交互中大(P <0.01)。研究支持了交互式大脑假说,这些发现提出了一种动态耦合的跨脑神经机制,专门用于共享人际信息。 口头任务基于完善的“对象命名和描述”任务,该任务通常用于fMRI的临床应用,其中人类语言系统的映射是神经外科计划的目标。在fMRI研究中,由于说话会产生头动从而在扫描中会造成大量伪迹,该任务通常以隐性(无声)语音执行。要求患者想象产生与命名和描述物体有关的语音。已通过术中记录证实了该任务激活的神经区域是布罗卡和威尔尼克区域。互动模式中,实验中的两名被试在对象命名和描述任务的时间序列如图1A所示。被试被随机分配到“描述者”和“聆听者”,角色每15秒切换一次。描述和聆听任务会持续3分钟,并重复两次。被试之间彼此隔绝,以防止混淆与语言相关的互动的面对面互动。两位被试观看的新图片出现表示任务开始。在控制条件下,即独白模式中,没有任何互动的独白者,要独自完成对图片的命名和描述。也会在不同的时间中,分别扮演“描述者”和“聆听者”。互动模式与独白模式的任务基本相同,不同之处在于,互动模式中,每一位描述者在对新的图片开始描述之前,都要对上一位描述者的评论做出评论。
图1.(A)两人对象命名和描述任务的实验范例。(B)42个通道的平均位置(红色圆圈)。(C-F)对deOxyHb(左列)和OxyHb(右列)信号的体素对比,C和D反映的是没有去除全局成分的原始信号,E,F是使用高通滤波去除全局成分后的信号。红色/黄色表示[描述>聆听],蓝色/青色表示[聆听>描述],其显著性级别由右侧的色条指示。图像包括左右组矢状面。E(左半球)中显示的三个圆圈代表规范语言区域:Broca区(前),Wernicke区(后)和关节运动系统(中枢)。
本研究共计招募62名健康成人(31组)。其中27组数据可用。单脑分析中,在排除的4组中,纳入4名没有伴侣且可用的被试数据(n = 58)。在实验之前,对被试进行筛选,通过执行两项任务来确定参加研究的资格:右手手指敲打任务和观看棋盘格任务。在这些实验中,活动和休息时期以15s的间隔交替进行,每个任务重复两次(每次三分钟)。如果在手指敲打任务的左手运动区域观察到相关的deOxyHb和OxyHb信号,在被动观察棋盘任务中有双侧枕叶的激活(P <0.05),则该参与者符合条件,并参与两人互动实验。被试配对是按招募顺序分配的,确保同伴在实验之前是陌生人,或者是偶然结识的同学,以防止产生额外变量。使用64光纤(84通道)连续波fNIRS系统(Shimadzu LABNIRS)收集血流动力学信号,该系统设置为对两个参与者进行脑扫描。图1B显示了在两个半球上42个通道的分布。通道间距通过个体头大小的差异进行调整,小头为2.75厘米,大头为3.0厘米。这样可以确保将无论其头部大小如何,发射器和探测器最佳地放置在每个被试的头皮上。由于光在组织中的传输的血液动力学反应还取决于包括组织的散射性质,光的波长,对象的年龄和颅骨厚度在内的因素。而测量的准确性随这些效应的变化而变化,这些差异被称为微分路径长度因子(DPF,differential pathlength factors)。尽管DPF最常用于额叶结构,但DPF模型的变化也会改变体感,运动和枕骨区域的敏感性。但是,由于本研究的头部覆盖范围大,并且通道位于未经DPF事先标准化的区域,因此未针对DPF调整这些数据。信号采集的时间分辨率为27ms。在LABNIRS系统中,每个发射器均发出三种波长的光(780、805和830 nm)。 使用3D定位仪对每个被试的通道进行定位(很重要,建议fNIRS实验室都予以配备)。使用NIRS-SPM获得MNI的通道坐标,并确定每个通道的相应解剖学位置。根据共享的解剖结构,将通道自动进一步聚类为解剖学区域,并将此分组用于跨脑相关性分析。每个区域的平均通道数为1.68±0.70。通过获取的通道中自动识别12个ROI,这些感兴趣区域包括:角回(BA39),背外侧前额叶皮层(BA9),背外侧前额叶皮层(BA46),额下回三角部(BA45),上臀回(BA40),梭状回(BA37),颞中回(BA21),颞上回(STG)(BA22),体感皮层(BA1、2和3),前运动皮层和辅助运动皮层(BA6),中央下区域(SCA)(BA43)和前极皮层(BA10)。使用小波分析(NIRS-SPM)去除基线漂移。当信号幅度大于平均信号的10倍时,会通过原始数据的均方根自动识别具有强噪声的通道。并假设这些事件是由于光源与头皮接触不足所致。根据此标准,大约4%的渠道被自动排除。先前研究表明,全身性整体影响(例如血压,呼吸和血流量变化)会改变相对血红蛋白浓度。在进行一般线性模型(GLM)分析之前,使用主成分分析空间滤波器去除全局成分。该技术通过消除由于来自全身心血管功能的整体活动引起的信号成分,从而利用分布式光电极覆盖范围的优势来区分来自局部信号源(与所研究的神经事件相关)的信号。fNIRS采集了deOxyHb和OxyHb信号。本研究的信号选择是根据两种数据(deOxyHb vs OxyHb)在不同实验条件下(独白 vs 互动)的语言区(描述, Broca; 聆听 ,Wernicke)中的比较来确定的。图1中,C和D反映的是未处理的原始信号,和使用高通滤波去除全局成分的信号(E和F)。最终本研究选择除去全局成分后的deOxyHb信号代表实际的描述和聆听任务。 ROI是通过对比两种情况下,描述和聆听数据的对比效果以及体素和信道信号处理方法来综合决定的。体素分析(图2,右图)使用了传统应用于fMRI的计算工具,并使用通道间finegrained 插值提供了最精确的活动空间位置。通道分析(图2,左图)提供了单个通道内的活动平均值的离散报告。最后,调整通道以覆盖所有被试相同的大脑区域。所有ROI均位于左半球。
图2.由功能决定的用于描述和聆听的ROI。独白和互动条件相结合,以分离出与描述(红色/黄色,描述>聆听)和聆听(蓝色,聆听>相关描述)的脑区。图左为通道分析,图右为体素分析。分析使用deOxyHb信号(n = 58)。
将每个被试的42通道fNIRS数据集重塑为3D脑图,以使用SPM8进行一级GLM分析。使用线性插值将Beta值标准化为标准MNI空间。排除距大脑表面≥1.8cm的体素。计算模板由3753个2×2×2 mm的体素组成,它们“平铺”了由42个通道覆盖的壳区域。跨被试的解剖变化用于生成分布式反应图。这种方法通过在被试之间和通道之间进行插值来提供空间分辨率优势。结果呈现在标准化的MNI模板的大脑上。参见图2,右图和表1。使用NIRS-SPM确定体素活性峰值的解剖位置。表1 ROI中:所有条件下,各通道的GLM对比(deOxyHb信号)
a坐标基于MNI系统,(-x)表示左半球; bBA,布洛卡脑区; c包含的可能性; dSTG,颞上回。尽管基于体素的分析通过从空间分布的信号计算出的插值活动提供了精确的空间定位估计,但是此方法提供了对数据的高度处理后的描述。本研究利用fNIRS的离散实际空间采样,使用单独的通道作为基本分析单元。将每个被试的通道位置转换为MNI空间,并使用非线性插值到中间位置。在标准化空间中,跨条件的比较将基于最初获取的离散通道单位而不是插值体素单位。参见图2,左图和表2。
表2 ROI中:所有条件下,体素水平的GLM对比(deOxyHb信号)

a坐标基于MNI系统,(-)表示左半球; bdf,自由度; cBA,布洛卡脑区; dSTG,颞上回。
所有报告的结果都通过两种分析进行观察,并用于确定本研究中使用的ROI。这些区域与使用无声语音功能磁共振成像以及当前人类语言系统模型确定的对象命名和描述任务的中的激活区一致。具体地说,在描述(生产性语言)中,活动区包括左半球opercularis部、三角部和额叶下回,以及左半球初级、运动前和辅助运动皮层(表1和表2,顶行)。对于聆听(接受性语言),活动区域包括左半球、STG、额上回、初级和联合听觉皮层以及梭状回(表1和表2,底部行)。总的来说,观察到的ROI包括用于发送和接收语言相关信息的规范区域,并提供了一个经验的和常规的框架来验证以下假设:在交互式交谈和倾听中使用的神经系统与在非交互式(独白)交谈和倾听中使用的神经系统是不同的。使用小波分析评估跨脑同步性(相干)。小波核是由MATLAB提供的复数高斯。八度音阶(octaves)为4,频率范围为0.4~0.025 Hz。每个Octaves的声音数也是4,因此使用了16个音阶(小波分析的参数),其波长差为2.5s。分析是通过使用相同类型的连接片段(谈话和倾听)进行的,并在整个数据时间序列中取相干值的平均值。这种方法提供了一种非对称耦合动力学的测量方法,其中听者的神经信号与说话者的神经信号同步,表示两个大脑之间可预测的转换。从预先定义的解剖区域获得的信号被分解成不同的时间频率,这些时间频率在去除任务回归变量后与每个二人组在两个大脑之间相关联,这是心理生理相互作用分析的常规方法。理论上,根据此技术对剩余信号进行分析,可以消除在指定的时间段内同时执行的不同任务(如说话和收听)引起的相关和反相关影响。在这里,剩余信号用于排除主要任务引起的效果以外的其他影响。根据功能定义的区域(图3),接收语言(聆听)的Wernicke脑区下ROI包括通道号30、36、37和42,而生产性(描述)语言的Broca脑区下ROI包括通道号34, 40和24。组平均信号强度显示在y轴上。独白和交互两种状态的统计比较(图3)分别显示了这两种ROI:Broca区域,左侧,红色条形图;和Wernicke的区域,右侧,蓝色条形图。水平虚线表示两种情况下的平均信号强度相等:独白和交互,交互信号强度大于独白信号强度为正的y值。Wernicke脑区的ROI的互动活动的平均信号显著强于独白活动的平均信号(P <0.04,t = 2.07,d = 57)(右图),但是Broca脑区ROI的独白和互动条件没有显著差异(左图)。
图3. Broca区和Wernicke区ROI信号幅值的统计比较(deOxyHb信号,n = 58)
除了上面的平均信号强度比较之外,我们还针对通道分析和体素分析对每个ROI的聚类分析进行了比较。图4A和B分别显示了交互式和非交互式(独白)条件的解剖学“热图”。在与[聆听>描述](蓝色)条件相关的团块激活的情况下,聚类大小从独白条件下的一个通道增加到交互条件下的五个相邻通道。这些结果与体素分析中体素数目的比较相似。表3(逐通道,独白)和4(逐体素,独白)和5(逐通道,独白,交互)和表6(逐体素,独白,交互)提供了体素/通道位置,解剖学标记,这些发现的统计指标和报告进一步证明了Wernicke区在互动条件的激活最高。
图4.对比结果。圆圈中的数字表示通道。红色和蓝色分别表示[描述>聆听]和[聆听>描述]。(deOxyHb信号,n = 58)。表3 独白条件下,通道水平GLM对比(deOxyHb信号)

表4 独白条件下,体素水平GLM对比(deOxyHb信号)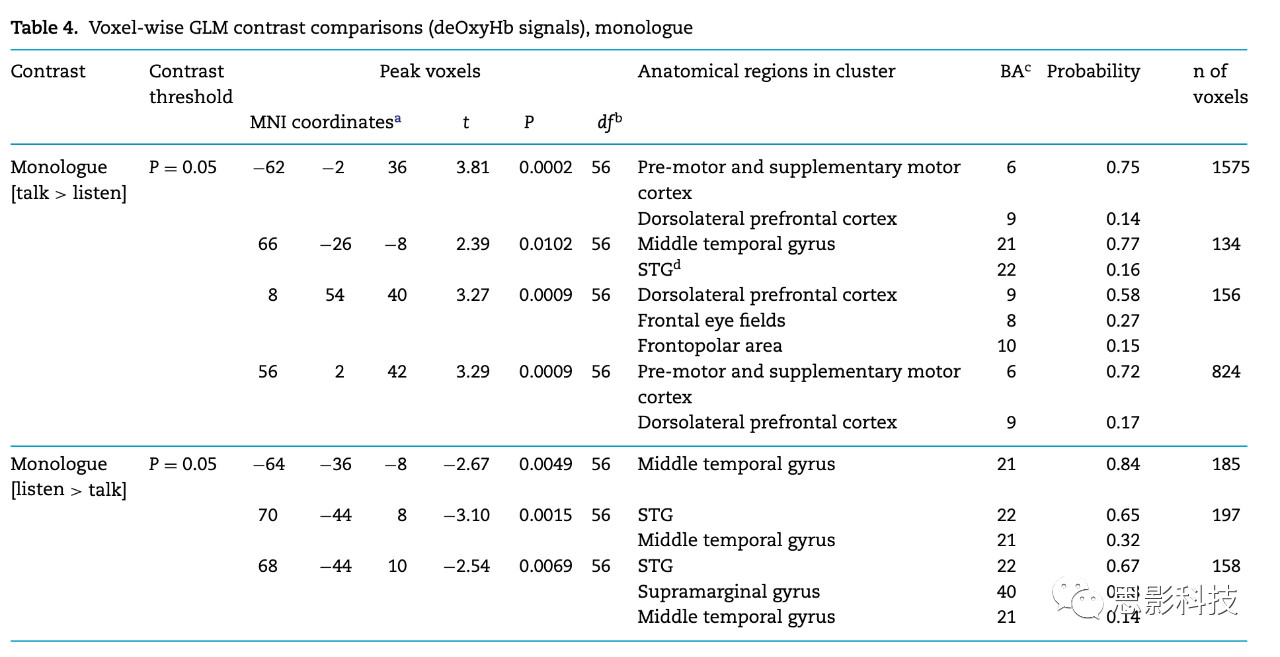
表5 互动条件下,通道水平GLM对比(deOxyHb信号)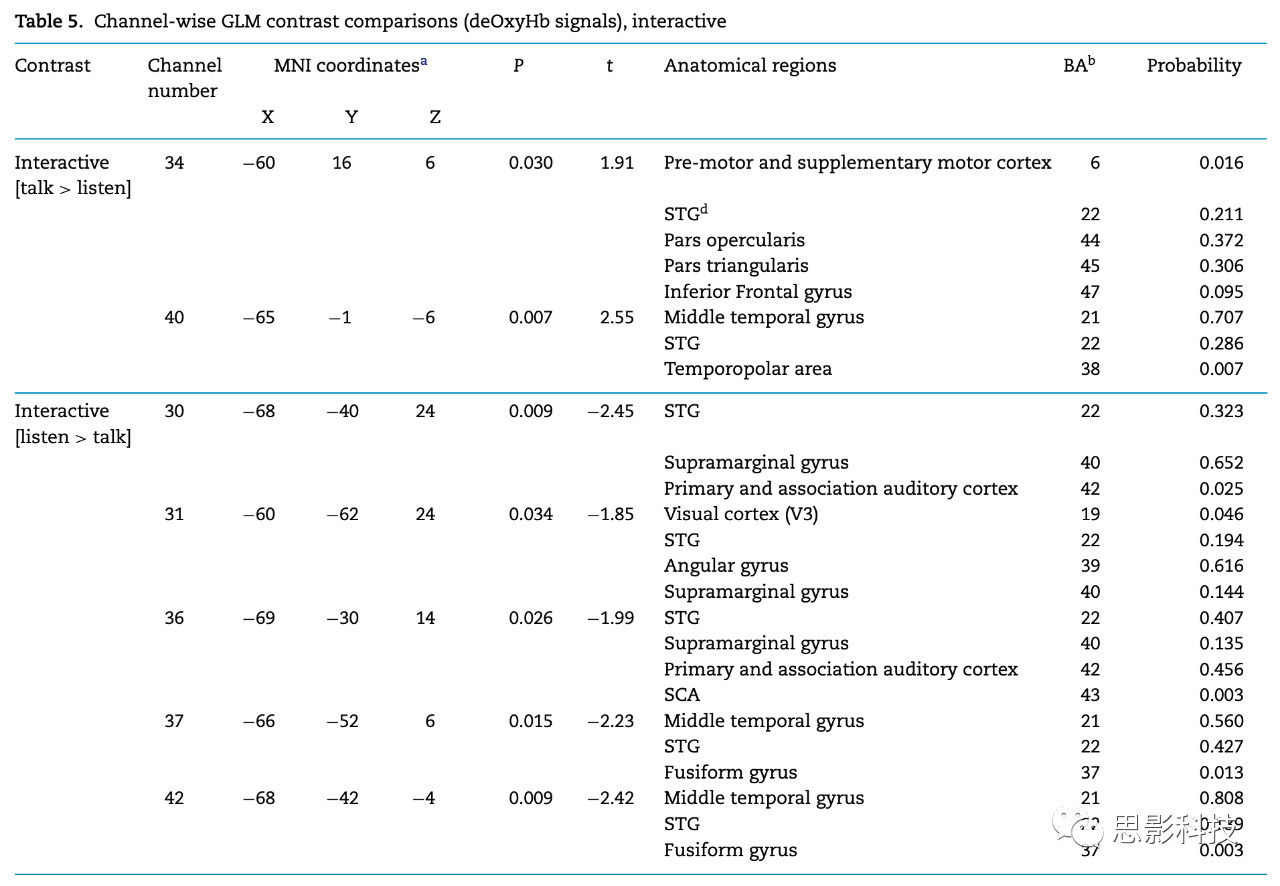
表6 互动条件下,体素水平GLM对比(deOxyHb信号)

a坐标基于MNI系统,(-)表示左半球; bdf,自由度; cBA,布洛卡脑区; dSTG,颞上回。在互动条件下,Wernicke脑区的颞上回(STG)和中下部地区(SCA)跨脑相干显著增强。STG的左右半球(大脑1)与SCA的左右半球(大脑2)耦合,反之亦然。将血流动力学信号分解成小波分量(图5,x轴)的时间振荡与参与描述和聆听联合任务(y轴)时获得的伙伴信号之间的相关性进行对比。在真实的伙伴中,8~14s之间的小波分析显示,交互(红色)条件下的跨脑相干比独白(蓝色)条件大,如5A图左所示(P <0.01)。但是,非真实伙伴(即随机与其他被试配对)中,没有统计上的区别。相干对(cohenrence pairs)的神经解剖如图5C所示。
本研究使用近红外的方法研究人与人之间口头交流的神经机制,证实了互动过程中,Wernicke区STG的相关的神经活动有所增加。通过小波分析对来自STG和中央下区域的信号进行分析,发现跨脑活动相干在交互过程中要比非交互性大,支持了交互式大脑假说。原文:A cross-brain neural mechanism for human-to-human verbal communication如需原文及补充材料请加微信:siyingyxf 或者19962074063获取,如对思影课程感兴趣也可加此微信号咨询。